pharmaceuticals
Simultaneous determination of aspirin and salicylic acid in water by high performance liquid chromatography with UV detection after pre-concentration by solid phase extraction (SPE)
Wstęp
Kwas acetylosalicylowy (aspiryna) jest powszechnie stosowany w lecznictwie, jako lek przeciwbólowy, przeciwzapalny, przeciwgorączkowy i w profilaktyce przeciwzakrzepowej. Od 120 lat jest najczęściej sprzedawanym lekiem na świecie (bez recepty) dostępnym pod różnymi nazwami (np. Aspirin, Polopiryna, Upsarin). Maksymalna dawka dobowa (MDD; ang.: Maximum Daily Dose) przy podaniu doustnym została ustalona na poziomie 4,0 g dla dorosłych oraz 1,5 g dla młodzieży powyżej 12 roku życia [1].
Zaliczany do niesteroidowych leków przeciwzapalnych kwas acetylosalicylowy jest substancją czynną, wrażliwą na czynniki hydrolityczne, jednak niezależnie od czynnika powodującego degradację, ścieżek rozkładu, metabolizmu oraz mechanizmów reakcji, finalnym produktem jego rozpadu jest kwas salicylowy – związek toksyczny dla ludzi i niebezpieczny dla środowiska. W związku z powszechnym stosowaniem kwasu acetylosalicylowego oraz jego właściwościami chemicznymi istnieje potencjalne zagrożenie zanieczyszczenia tym związkiem i produktami jego rozkładu wód powierzchniowych ujmowanych na potrzeby zaopatrzenia ludności w wodę przeznaczoną do spożycia i w mniejszym stopniu wód podziemnych.
Wyniki badań potwierdzają, że ścieki komunalne zawierając pozostałości leków mogą być istotnym źródłem zanieczyszczenia środowiska [2]. Wykryte w ściekach pozostałości środków farmaceutycznych, z uwagi na swoistą aktywność biologiczną, należy zaliczyć do związków potencjalnie niebezpiecznych szczególnie dla środowiska wodnego. Proces oczyszczania ścieków nie usuwa całkowicie tych związków i mogą one w postaci niezmienionej lub pośrednich metabolitów przedostawać się do środowiska wodnego. Ponadto szacuje się, że pozostałości leków mogą ulegać kumulacji w organizmach żywych [3]. W wodach powierzchniowych rzek z terenu Polski (Odra, Warta) kwas acetylosalicylowy i kwas salicylowy oznaczono na poziomach odpowiednio z zakresów 0,3-0,7 μg/l i 0,1-0,2 μg/l [4].
Obecność pozostałości leków (w tym aspiryny) w wodzie nie podlega monitoringowi w ramach Dyrektywy Rady 98/83/WE z dalszymi zmianami [5,6] oraz Rozporządzenia Ministra Zdrowia z dnia 7 grudnia 2017 roku w sprawie jakości wody przeznaczonej do spożycia przez ludzi [7], a w związku z tym nie ustalono najwyższego dopuszczalnego stężenia tego związku w wodzie przeznaczonej do spożycia. Chociaż jest on relatywnie mało toksyczny (LD50 dla myszy i szczura przy podaniu doustnym wynosi odpowiednio 1,1 g/kg m.c. i 1,5 g/kg m.c. [8]) to jego produkt hydrolizy – kwas salicylowy jest związkiem bardziej toksycznym (LD50 dla myszy 500 mg/kg m.c. [9]).
Celem pracy było opracowanie i zwalidowanie czułej metody jednoczesnego oznaczania kwasu acetylosalicylowego (aspiryny) i kwasu salicylowego w wodzie techniką wysokosprawnej chromatografii cieczowej z detekcją w zakresie ultrafioletu po wstępnym zatężaniu analitów z wykorzystaniem ekstrakcji do fazy stałej (SPE) oraz analiza pilotażowych próbek wody przeznaczonej do spożycia przez ludzi.
Aparatura
Do oznaczeń kwasu acetylosalicylowego (ASP) i kwasu salicylowego (SAL) zastosowano wysokosprawny chromatograf cieczowy Summit PAN (Dionex, Niemcy) sterowany oprogramowaniem Chromeleon. Do rozdzielenia analitów zastosowano kolumnę nowej generacji Develosil XG-C30M (150×4,6 mm, 3 μm), firmy Nomura Chemical Co. Ltd. wraz z przedkolumną ochronną o takim samym wypełnieniu (10×4,6 mm).
Etap oznaczania poprzedzony był etapem zatężania ASP i SAL za pomocą ekstrakcji do fazy stałej na kolumienkach SPE (ang.: Solid Phase Extraction) typu Oasis HLB (ang. Hydrophilic Lipophilic Balance) wypełnionych kopolimerem N-winylopirolidonu z diwinylobenzenem – 500 mg/ 6 ml (Waters, USA).
Opis zoptymalizowanej metody jednoczesnego oznaczenia kwasu acetylosalicylowego (aspiryny) i kwasu salicylowego w wodzie techniką HPLC-PDA
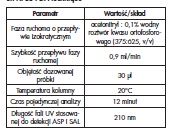
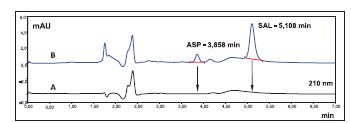
Badano możliwość jednoczesnego oznaczania kwasu acetylosalicylowego i kwasu salicylowego w wodzie podczas jednego procesu analitycznego przy użyciu detektora z matrycą diodową PDA (ang.: Photodiode Array). Przeprowadzono optymalizację parametrów aparaturowych i rozdzielania chromatograficznego. Badano stabilność analitów i uzyskiwane czułości w zależności od składu, przepływu i temperatury fazy ruchomej. Do rozdzielania ASP i SAL zastosowano kolumnę Develosil XG-C30M (150×4,6 mm, 3 μm) przy objętości wstrzykiwanej próbki – 30 μl. Skład fazy ruchomej obejmował acetonitryl i 0,1% wodny roztwór kwasu ortofosforowego (375:625, v/v), przy przepływie 0,9 ml/min w temperaturze 20°C. W tych warunkach czas retencji ASP wynosił 3,8 min, natomiast SAL – 5,1 min (detekcja przy długości fali UV – 210 nm). Kalibracje przeprowadzano w zakresie stężeń 100-500 ng/ml (ASP i SAL). Do przyrządzania roztworów kalibracyjnych stosowano wzorzec aspiryny o czystości 99,4% (Fluka Analytical / Sigma-Aldrich, USA) i kwasu salicylowego o czystości 99,96% (Sigma-Aldrich, USA).
W celu obniżenia uzyskiwanych granic oznaczalności, kwas acetylosalicylowy i kwas salicylowy obecne w próbce wody były zatężane za pomocą ekstrakcji do fazy stałej na kolumienkach SPE (ang.: Solid Phase Extraction) typu Oasis HLB (ang. Hydrophilic Lipophilic Balance) wypełnionych kopolimerem N-winylopirolidonu z diwinylobenzenem – 500 mg/ 6 ml (Waters, USA). Kolumienki SPE kondycjonowano za pomocą porcji metanolu o objętości 6 ml, a następnie dwóch porcji wody dejonizowanej uzyskanej w systemie Simplicity 185 (SAS Millipore, Francja) o objętościach 6 ml, przy czym nie dopuszczano do przesuszenia złoża. Po etapie kondycjonowania próbki wody o objętościach 0,5 l przepuszczano przez kolumienki SPE z przepływem nie większym niż 3 ml/min (ok. 1 kropla/s), kontrolując podciśnienie 12-pozycyjnego systemu SPE-12G (J.T. Baker, USA) poprzez regulację położeń zaworów króćców z PTFE oraz zaworu głównego sprzężonego z manometrem. Po przepuszczeniu całych próbek wody przez kolumienki SPE, odwirowywano pozostałość wody ze złóż z prędkością 4000 obrotów/min przez 10 minut, a następnie stosowano suszenie pod próżnią. Anality wymywano z kolumienek do odbieralników za pomocą czterech porcji dimetoksymetanu (DMM) o objętościach 1,0 ml. Po odparowaniu DMM suchą pozostałość rozpuszczano w 1 ml fazy ruchomej i przelewano do szczelnie zakręcanych naczynek szklanych automatycznego podajnika próbek. Przygotowana w wyżej opisany sposób próbka była poddawana analizie za pomocą techniki HPLCPDA w układzie izokratycznym.
Wyniki i dyskusja
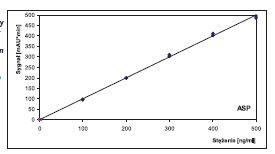
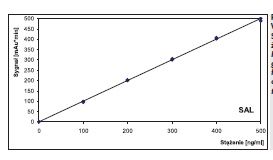
Kalibracje w zakresie stężeń 100-500 ng/ ml (ASP i SAL) charakteryzowały się współczynnikami korelacji wynoszącymi 0,9988 (ASP) i 0,9994 (SAL). Wyznaczone granice wykrywalności i oznaczalności ASP oraz SAL (bez etapu zatężania analitów z próbek wody) wynosiły odpowiednio: 1,0 ng/ml i 2,0 ng/ml oraz 2,7 ng/ml i 5,4 ng/ml.
W przypadku zastosowania wstępnego etapu zatężania analitów uzyskane granice wykrywalności i oznaczalności ASP oraz SAL wynosiły odpowiednio: 7 i 14 ng/l oraz 14 i 28 ng/l. Średnie odzyski wynosiły 82% (ASP) i 73% (SAL), przy uzyskiwanej poprawności metody do 20%, natomiast precyzja (RSD) wyznaczona na poziomie 200 ng/l ASP i SAL odpowiednio 3,4% i 2,3%.
Przy zastosowaniu zoptymalizowanych warunków przedstawionych w tabeli 1 czasy retencji sygnałów wzorców aspiryny (ASP) i kwasu salicylowego (SAL) wynosiły odpowiednio 3,8 min i 5,1 min.
Typowe wykresy kalibracyjne kwasu acetylosalicylowego i kwasu salicylowego przedstawiono odpowiednio na rys. 1 i rys. 2.
Wyznaczanie stężeń oznaczanych analitów w próbkach wody odbywało się poprzez zastosowanie funkcji kalibracji opartych na regresji liniowej pierwszego stopnia. Do obliczeń stosowane były pola powierzchni sygnałów analitów. W celu przeliczenia oznaczonych stężeń analitów w próbkach wody po zatężeniu metodą SPE wyrażonych w ng/ml na zawartości analitów w pobranych do analizy próbkach wody wyrażonych w ng/l uwzględniano współczynniki przeliczeniowe odzysków (α = 100%/W%) – obliczone na podstawie wyznaczonych wartości średnich odzysków (W%) oraz współczynnik wynikający z procedury zatężania próbek (WYNIK [ng/l] = wynik [ng/ml] · 2α).
Próbki wody do badań pobierano do butelek ze szkła oranżowego oraz transportowano i przechowywano do momentu analizy w temperaturze 4oC±2,5oC, zabezpieczając przed działaniem światła, nie dłużej niż 24 godziny od momentu ich pobrania.
Próbki wody przeznaczonej do spożycia pobrano w grudniu 2017 roku z kranów konsumentów ze strefy zaopatrzenia Zakładu Wodociągu Centralnego w Warszawie.
Na rysunku 3 przedstawiono chromatogramy: próbki wody przeznaczonej do spożycia po zatężaniu ww. związków za pomocą techniki SPE i roztworu kalibracyjnego kwasu acetylosalicylowego i kwasu salicylowego (100 ng/ml). W badanych próbkach wody nie stwierdzono obecności ww. analitów na wyższych poziomach niż odpowiadające granice oznaczalności.
Optimized chromatographic separation and apparatus parameters of the method based on HPLC-PDA technique
Wnioski
Opracowana metoda pozwala na jednoczesne oznaczanie kwasu acetylosalicylowego (ASP) i kwasu salicylowego (SAL) w wodzie techniką wysokosprawnej chromatografii cieczowej z detektorem z matrycą diodową (HPLC-PDA).
Zastosowanie wstępnego etapu zatężania tych związków za pomocą ekstrakcji do fazy stałej SPE umożliwiło obniżenie granic oznaczalności tych związków o ponad dwa rzędy wielkości do poziomów: 14 ng/l (ASP) i 28 ng/l (SAL), przy uzyskiwanych odzyskach powyżej 70% i poprawnością oznaczeń nie gorszą niż 20%.
W badanych próbkach wody przeznaczonej do spożycia pobranej ze strefy zaopatrzenia Zakładu Wodociągu Centralnego w Warszawie nie stwierdzono obecności kwasu acetylosalicylowego i kwasu salicylowego na poziomach wyższych niż ww. granice oznaczalności. Przeprowadzone badania potwierdzają znikome narażenie ludzi na te związki występujące w wodzie przeznaczonej do spożycia uzyskiwanej w zakładzie wodociągowym stosującym zaawansowane procesy uzdatniania (w tym sorpcję na węglu aktywnym).
Podziękowania
Praca została sfinansowana w ramach tematu badawczego „Narażenie na czynniki chemiczne występujące w środowisku człowieka” – projekt 7/ZŚ.2. „Badanie zawartości kwasu salicylowego w wodzie jako finalnego produktu degradacji kwasu acetylosalicylowego” realizowanego w latach 2016-2017.
L I T E R AT U R A
[1] Pharmindex Brevier – Podręczny Indeks Leków 2007/2, CMP Medica Poland, Warszawa.
[2] U. Kotowska, M. Jasińska. Analiza jakościowa śladowych zanieczyszczeń organicznych w ściekach komunalnych z miast północnowschodniej Polski. Inżynieria i Ochrona Środowiska 14 (3), 2011, 223-232.
[3] A. Koszowska, M. Ebisz, T. Krzyśko-Łupicka, Obecność farmaceutyków i środków kosmetycznych w środowisku wodnym jako nowy problem zdrowia środowiskowego Medycyna Środowiskowa – Environmental Medicine 18(1), 2015, 62-69
[4] I. Baranowska, B. Kowalski. Using HPLC Method with DAD Detection for the simultaneous determination of 15 drugs in surface water and wastewater. Polish Journal of Environmental Studies 20, 2011, 21-28.
[5] Council Directive 98/83/WE of 3 November 1998 on the quality of water intended for human consumption. Official Journal of the European Communities, 1998, L 330, 32-54.
[6] Commission Directive (EU) 2015/1787 of 6 October 2015 amending Annexes II and III to Council Directive 98/83/EC on the quality of water intended for human consumption. Official Journal of the European Union, 2015, L 260, 6-17.
[7] Rozporządzenie Ministra Zdrowia z dnia 7 grudnia 2017 r. w sprawie jakości wody przeznaczonej do spożycia przez ludzi (Dz.U. z 11.12.2017 r., poz. 2294).
[8] The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals 14th edition, Published by Merck Research Laboratories, Merck & Co., Inc., 2006, monograph 851, p. 140.
[9] The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals 14th edition, Published by Merck Research Laboratories, Merck & Co., Inc., 2006, monograph 8332, p. 1438.
Study of the effectiveness of diclofenac removal from treated wastewater using Polish ozonation technology
Wstęp
Farmaceutyki to aktywne biologicznie związki, stosowane głównie w medycynie i weterynarii. Do tej grupy należą tysiące związków chemicznych o specyficznych właściwościach biologicznych i fizykochemicznych [11], a liczba ta będzie ciągle rosnąć, z uwagi na to, iż zarówno medycyna, jak i weterynaria, cały czas starają się znaleźć nowe sposoby leczenia chorób. Duże zróżnicowanie właściwości fizykochemicznych tych substancji i ich złożona budowa chemiczna często powodują, że są one bardzo trudne do wykrycia i następnie do usunięcia ze środowiska [13].
Naukowcy od wielu lat zwracają uwagę na duży wpływ oddziaływania przemysłu farmaceutycznego na środowisko naturalne. Obecność w nim farmaceutyków jest bardzo niebezpieczna nie tylko dla ludzi, ale także dla roślin i zwierząt. Jedną z najważniejszych dróg przedostawania się tych związków do wód jest ich występowanie w ściekach oczyszczonych wypływających z oczyszczalni ścieków. Dzieje sie tak dlatego, że w większości procesów stosowanych obecnie do oczyszczania ścieków usuwa się tylko niewielką część związków należących do szerokiej grupy mikrozanieczyszczeń. W związku z tym najbardziej oczywistym rozwiązaniem tego problemu było opracowanie metody, umożliwiającej całkowite ich wyeliminowanie z odpływu z oczyszczalni. Ze względu na to, iż farmaceutyki i ich metabolity to jedne z najtrudniejszych zanieczyszczeń do usunięcia z wody lub ścieków [12], konieczne jest przeprowadzenie badań, w celu znalezienia skutecznych metod ich usuwania. Wykazano, że zastosowanie technologii, takich jak: procesy membranowe, adsorpcja na granulowanym węglu aktywnym, czy metody pogłębionego utleniania, w tym ozonowanie, mogą być efektywne w usuwaniu mikrozanieczyszczeń [1]. Obecnie, wyzwaniem jest takie opracowanie sposobów prowadzenia tych procesów, aby osiągnąć jak największą skuteczność usuwania tych związków, zapewniając jak największy poziom bezpieczeństwa wody dla ludzi oraz całego środowiska naturalnego.
Pionierem w usuwaniu farmaceutyków ze ścieków jest Szwajcaria. W styczniu 2016 roku wprowadzono tam w życie nową ustawę, której głównym celem jest polepszenie jakości wód powierzchniowych, między innymi poprzez zmniejszenie ilości farmaceutyków w odpływach z oczyszczalni ścieków [2]. Zgodnie z tą ustawą, w przeciągu kolejnych 20 lat, sto z istniejących około siedmiuset oczyszczalni ścieków w Szwajcarii będzie musiało wprowadzić do ciągu technologicznego proces, który umożliwi usuwanie mikrozanieczyszczeń, w tym w szczególności pozostałości farmaceutyków.
W celu zapewnienia skuteczności rozwiązań stosowanych w tych oczyszczalniach ścieków, wyszczególniono listę 12 substancji wskaźnikowych, które muszą być usuwane ze skutecznością, uśrednioną dla wszystkich substancji, wynoszącą co najmniej 80%. Tę grupę tworzą między innymi związki, takie jak: diklofenak, karbamazepina i citalopram.
Wybrano właśnie te związki z uwagi na to, iż są one w niewielkim stopniu biodegradowalne, przez co są w bardzo małym stopniu usuwane w konwencjonalnych procesach oczyszczania ścieków [2].
Konsekwencją prac badawczych i legislacyjnych prowadzonych w Szwajcarii, dotyczących obecności farmaceutyków w wodach naturalnych, było między innymi zmodernizowanie oczyszczalni ścieków Neugut w miejscowości Dübendorf (105000 RLM). Jest to pierwsza oczyszczalnia ścieków w Szwajcarii, w której wprowadzono proces ozonowania na pełną skalę, w celu usuwania farmaceutyków ze ścieków. Oczyszczalnię otwarto w marcu 2014 r. i aktualnie usuwa ona około 80-90% wszystkich mikrozanieczyszczeń, oraz w znacznej liczbie eliminuje bakterie i wirusy z 20-50 milionów litrów ścieków dziennie.
Diklofenak
Diklofenak to powszechnie stosowany niesteroidowy lek przeciwzapalny (NLPZ), z grupy pochodnych kwasu octowego [8]. Wzór chemiczny diklofenaku to C14H11Cl2NO2 [14]. Diklofenak charakteryzuje się silnym działaniem przeciwzapalnym, przeciwgorączkowym i przeciwbólowym [8].
Według danych, w Polsce w roku 2000, zużyto 20 879 kg tej substancji, natomiast w Niemczech w roku 2001 aż 49000 kg [6]. Stopień wchłaniania diklofenaku przez organizm zmienia się, ponieważ jest zależny od formy leku. Po spożyciu doustnym biodostępność leku wynosi od 30 do 80%, średnio 50% [8], co wpływa na to, że stosunkowo duża ilość leku nie jest metabolizowana i po przejściu w stanie niezmienionym przez organizm przedostaje się do kanalizacji. W Polsce, diklofenak jest składnikiem takich preparatów znajdujących się w sprzedaży, jak: Diclac, Naklofen czy Voltaren [8].
Przeciętna skuteczność usuwania diklofenaku w oczyszczalniach ścieków wykorzystujących technologię osadu czynnego wynosi od 0 do 80%, jednakże najczęściej wynosi ona od 21 do 40%. Jest ona spowodowana zjawiskiem adsorpcji na kłaczkach osadu [9]. Powoduje to, że na przykład w ściekach oczyszczonych w Niemczech, mediana wykrywanych stężeń diklofenaku jest równa 1500 ng/dm3, natomiast maksymalne wykryte stężenie wyniosło 10000 ng/ dm3. Natomiast wodach powierzchniowych za naszą zachodnią granicą, te wartości wynoszą 30 ng/dm3 oraz 470 ng/dm3 [6]. W Polsce, wykrywane stężenia diklofenaku w wodach powierzchniowych mieszczą się w zakresie od 17 do 486 ng/dm3 [10].
Ozonowanie jako metoda usuwania farmaceutyków
Wiele testów pilotażowych dowiodło, że ozonowanie ma wysoki potencjał utleniania farmaceutyków w wodzie i ściekach i jest uważane za najbardziej perspektywiczną i skuteczną metodę, którą można wprowadzić w skali technicznej do już istniejących oczyszczalni ścieków.
Mikrozanieczyszczenia mogą być utleniane nie tylko przez bezpośrednie działanie ozonu na cząsteczkę, ale także poprzez działanie rodników hydroksylowych ·OH. Te dwa utleniacze znacznie różnią się pod względem reaktywności, ze względu na to, iż ozon działa wyłącznie na wybrane, natomiast rodniki bardzo szybko reagują z szerokim spektrum grup funkcyjnych [5].
W przypadku wykorzystywania ozonowania do usuwania farmaceutyków ze ścieków, konieczne jest prowadzenie tego procesu na dobrze oczyszczonych ściekach. Chodzi o to, aby wykorzystać silne działanie utleniające ozonu w kierunku dedykowanych do tego zanieczyszczeń, a nie tych, które mogą być usunięte przy użyciu klasycznych metod oczyszczania ścieków. Substancje w cieczy „konkurują ze sobą” o ozon, czyli w przypadku podwyższonych stężeń określonych substancji, może się okazać, że nie wystarczy go do utlenienia farmaceutyków. Pokazuje to jak ważne dla skuteczności ozonowania są wszystkie procesy technologiczne wykorzystywane w oczyszczalni ścieków przed tym procesem. Niskie wartości OWO i azotynów są kluczowe w przypadku ozonowania. Jest to spowodowane tym, że większa ilość materii organicznej, jak i opisywanej formy azotu, automatycznie wpływa na konieczność stosowania większych dawek ozonu, aby osiągnąć wysoką skuteczność usuwania farmaceutyków ze ścieków.
Zastosowanie procesu ozonowania w oczyszczaniu ścieków powinno zostać poprzedzone dokładnym oszacowaniem bezpieczeństwa prowadzenia tego procesu. Jest to związane z tym, iż reakcje ozonu w niektórych cieczach mogą prowadzić do powstawania potencjalnie toksycznych produktów ubocznych procesu ozonowania. Także z tego względu, zaleca się wprowadzanie instalacji wykorzystujących ozon, razem z następującym po nich biologicznie aktywnym procesem, jak na przykład filtracja na złożach żwirowo piaskowych.
Badania nad usuwaniem farmaceutyków ze ścieków
W oczyszczalni ścieków zlokalizowanej w województwie śląskim, w lutym 2018 roku, przeprowadzono badania obecności kilku farmaceutyków w ściekach surowych oraz wypływających z osadnika wtórnego. Otrzymane wyniki prezentują wysokie stężenia w ściekach dopływających takich związków, jak: naproksen, diklofenak, ibuprofen oraz 4-hydroksy-diklofenak. Wymienione w tabeli związki to popularne farmaceutyki, dlatego ich wykrycie w ściekach nie jest zaskoczeniem, jednak ich stężenia już tak. Otrzymane wyniki wskazują na to, iż pomimo poboru próbek w niewielkich odstępach czasu, wyniki znacząco różnią się od siebie. Bardzo interesujące wyniki otrzymano badając ścieki oczyszczone i porównując je ze stężeniami farmaceutyków wykrytych w ściekach surowych. W przypadku ibuprofenu oraz naproksenu zaobserwowana została niemalże 100% skuteczność usuwania po klasycznych metodach oczyszczania ścieków. Jest to związane głównie z pracą reaktora biologicznego, choć badania wykazały, że już w części mechanicznej oczyszczalni ścieków może zostać usunięta część wyżej wymienionych farmaceutyków. Stężenia diklofenaku oraz 4-hydroksydiklofenaku w ściekach oczyszczonych były większe niż w ściekach surowych. Wpływ na to ma najprawdopodobniej nierównomierność stężeń farmaceutyków w ściekach dopływających do oczyszczalni, choć rezultaty te mogą mieć także inne podłoże.
Oczyszczalnia ścieków, w której przeprowadzono badania charakteryzuje się obciążeniem wyrażonym wartością RLM równą 125 000. Oczyszczane są ścieki dopływające do oczyszczalni kolektorem ogólnospławnym, dopływ średni dobowy wynosi 25 000 m3/d. W skład linii oczyszczania ścieków wchodzą takie urządzenia, jak: kraty, piaskowniki, osadnik wstępny, wielofazowy reaktor biologiczny w układzie JHB oraz osadniki wtórne.
Opis stacji pilotowej
Stacja pilotowa jest zespołem urządzeń odwzorowujących rzeczywiste procesy technologiczne możliwe do wykorzystania w oczyszczaniu ścieków. Urządzenie zostało wyprodukowane przez polską firmę Wofil Robert Muszański. Jest to urządzenie wykorzystywane do prowadzenia badań, które może być używane do precyzyjnego projektowania kompletnych instalacji wraz z doborem parametrów pracujących urządzeń. Na potrzeby badań wykorzystano stację pilotową, która pozwala na zastosowanie następujących procesów w oczyszczaniu ścieków:
- stopniowanie napowietrzania powietrzem zjonizowanym;
- filtracja
- stopnia na złożu żwirowopiaskowym;
- ozonowanie pośrednie w wielostopniowych kolumnach kontaktowych ograniczających zużycie ozonu;
- filtracja II stopnia na złożu żwirowopiaskowym;
- filtracja na złożu z węgla aktywnego.
Ścieki oczyszczone doprowadzane są ciśnieniowo do stacji pilotowej, gdzie na wejściu mierzone i regulowane jest natężenie przepływu. Ciecz wpływa do aeratora, w którym następuje proces usunięcia potencjalnie występujących cząstek rozpuszczonych gazów oraz stopniowanie napowietrzenia ścieków powietrzem zjonizowanym. Ma to na celu wstępne utlenienie niektórych związków w cieczy. Z uwagi na wykorzystywanie w aeratorze powietrza zjonizowanego, skuteczność prowadzenia procesów napowietrzania jest wyższa, niż w przypadku wykorzystywania zwykłego powietrza.
Po procesie napowietrzania, woda jest tłoczona do kolejnego procesu technologicznego jakim jest filtracja I stopnia na złożu żwirowo-piaskowym. Wewnątrz filtra wykorzystano wysokiej jakości naturalny piasek kwarcowy. Następnie ścieki przepływają do bloku ozonowania.
W bloku ozonowania, ścieki przepływają przez mieszacz statyczny i dopływają do pierwszej kolumny kontaktowej, którą zaczynają wypełniać. Konstrukcja kolumn pozwala na ustalenie tego samego czasu kontaktu dla różnych przepływów, jak i różnego czasu kontaktu dla takiego samego przepływu, co jest niezwykle ważne przy badaniach pilotowych procesu ozonowania. Jest to rozwiązanie, które zapewnia stały czas kontaktu ścieków z ozonem, przy zmiennych przepływach. Żadne ze stosowanych rozwiązań na świecie nie pozwala na uzyskanie takiego efektu. Przykładowo, w omawianej wcześniej oczyszczalni ścieków w Szwajcarii, czas kontaktu ścieków z ozonem waha się od 13 do 43 minut (McArdell, 2018), co zwiększa prawdopodobieństwo powstawania szkodliwych produktów ozonowania. Natomiast w rozwiązaniu WOFIL układ wprowadzania ozonu zapewnia precyzyjną pracę systemu oraz bezpieczeństwo prowadzenia procesu. Ozon wytwarzany jest w generatorze ozonu chłodzonym powietrzem. Ozonator jest urządzeniem pracującym w technologii nietermicznej plazmy, w którym możliwa jest płynna regulacja mocy w zakresie wydajności od 1–100%. Do wytwarzania ozonu wykorzystywany jest czysty tlen wytwarzany na miejscu przez wytwornicę tlenu. W procesie ozonowania, ozon desorbujący znad lustra cieczy w kolumnach kontaktowych jest mieszany z filtrowanym powietrzem, tworząc w ten sposób powietrze zjonizowane. Jest ono wprowadzane do aeratora w systemie stopniowania procesów utleniania
Po procesie ozonowania, ścieki poddawane są kolejnemu procesowi technologicznemu, którym jest filtracja II stopnia na złożu żwirowo-piaskowym. Ma ona za zadanie usunięcie produktów procesu utleniania i odpowiednie przygotowanie ścieków do kolejnych procesów takich, jak: filtracja na węglu aktywnym i opcjonalnie dezynfekcja na lampach UV.
Metodyka badań
Badania przeprowadzono w dniu 14 czerwca 2018 r., w godzinach porannych, w oczyszczalni ścieków zlokalizowanej w województwie śląskim. Stacja pilotowa w trakcie testów umieszczona była na samochodzie ciężarowym, który został ustawiony w pobliżu kanału wylotowego z oczyszczalni, którym przepływają ścieki po osadniku wtórnym.
W kanale odpływowym umieszczono małą zatapialną pompę do ścieków, która tłoczyła ścieki do beczki znajdującej się w pobliżu samochodu. W beczce umieszczono drugą pompę zatapialną, która doprowadzała ścieki na wejście stacji pilotowej.
Przewód tłoczny pompy w beczce podłączono do wejścia stacji pilotowej. Badania przeprowadzono przy natężeniu przepływu ścieków równym 1 m3/h. Badania były prowadzone przy ustalonej dawce ozonu i stałym czasie kontaktu. Wielkość obciążenia urządzeń technologicznych dostosowano do wartości z badań prowadzonych w Szwajcarii, aby porównawczo sprawdzić efektywność całego procesu.
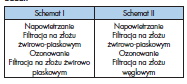
Przyjęto, że stacja pilotowa pracować będzie według dwóch schematów przedstawionych poniżej, w tabeli 4.2. Stację przed włączeniem ustawiono wg pierwszego schematu pracy.
Po pierwszym włączeniu stacji, pracowała ona według pierwszego schematu przez około 2 godziny. Najpierw pobrano próbki ścieków surowych. Następnie, przystąpiono do pomiaru ozonu resztkowego po procesie ozonowania. Badanie to miało na celu sprawdzenie, jaka ilość dozowanego ozonu do cieczy pozostaje w nim po procesach utleniania w kolumnach kontaktowych. W kolejnym kroku pobrano próbki ścieków po procesie ozonowania a następnie, po II stopniu filtracji na złożu żwirowo-piaskowym.
Po pobraniu wszystkich próbek z pracy stacji według pierwszego schematu, przestawiono ją na pracę według schematu drugiego. Konieczne było odczekanie niezbędnego czasu, który pozwolił na to, aby ścieki przepłynęły przez filtr węglowy. Ponownie skontrolowano stężenie ozonu resztkowego po procesie ozonowania. Następnie, przystąpiono do poboru próbek ścieków po procesie filtracji na złożu z węgla aktywnego.
Analiza wyników
Badanie stężenia ozonu resztkowego w ściekach przeprowadzono dwukrotnie w odstępie 45 minut według każdego ze schematów pracy stacji pilotowej. Wartość ozonu resztkowego w trakcie badań utrzymywała się na stałym poziomie. Było tak niezależnie od realizowanego schematu pracy instalacji pilotowej, co wskazuje na bardzo zbliżone parametry ścieków wypływających z osadnika wtórnego w czasie oraz stabilną pracę układu. Odpowiednie dobranie dawki ozonu ma duże znaczenie dla skuteczności procesu i powinno być przeprowadzane przez doświadczoną w tym osobę.
Próbki ścieków pobrano do przezroczystych, plastikowych butelek, o pojemności 500 ml. każda. Dzięki temu możliwe było zaobserwowanie zmiany barwy cieczy po przeprowadzonych procesach. Ścieki surowe charakteryzowały się delikatnie żółtawą barwą, która w dużym stopniu została zredukowana po procesie ozonowania. Można było spodziewać się takiego efektu, z uwagi na to, iż ozonowanie jest jedną ze skuteczniejszych metod usuwania barwy z cieczy. Po procesie filtracji na złożu piaskowym barwa była niemalże identyczna jak po ozonowaniu. Z drugiej strony, ścieki przefiltrowane na złożu z węgla aktywnego nie były tak przezroczyste, jak te bezpośrednio po utlenianiu ozonem. Prawdopodobnie, związane jest to z bardzo krótkim czasem pracy filtra węglowego i procesem przedostawania się mikroskopijnej frakcji materiału filtracyjnego przez filtr. Złoże z węgla aktywnego po wpracowaniu wpłynęłoby na redukcję barwy ścieków. Dodatkową rzeczą, którą zaobserwowano w butelkach było występowanie bardzo drobnej, białej zawiesiny w próbce ścieków po osadniku wtórnym. Potwierdziło to sens stosowania filtracji I stopnia na złożu żwirowo-piaskowym przed procesem ozonowania, z uwagi na to, iż w jego trakcie zostaje usunięta wspomniana zawiesina, która powodowałaby zwiększenie zapotrzebowania na ozon w procesie utleniania zanieczyszczeń.
Badanie stężenia azotynów w ściekach przeprowadzono dla każdej z pobranych w trakcie badań próbek. Azotyny bardzo szybko reagują z ozonem, są utleniane do azotanów. Dlatego możliwe jest wystąpienie sytuacji, w której podwyższone stężenie azotynów w ściekach spowoduje spadek skuteczności usuwania farmaceutyków.
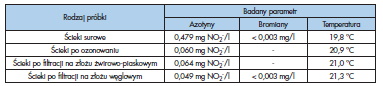
W powyższej tabeli widać, że stężenie azotynów w ściekach po osadniku wtórnym jest niemalże na poziomie, dla którego zalecane jest stosowanie podwyższonych dawek ozonu. Skuteczność usuwania azotynów w procesie ozonowania, była na poziomie około 88 %. Zauważalny jest niewielki wzrost stężenia jonów NO2 – po filtracji na złożu żwirowo-piaskowym, co może mieć związek z małymi różnicami w jakości ścieków surowych w czasie badania lub niepewnością pomiarową przy użyciu spektrofotometru.
Badanie stężenia bromianów w ściekach przeprowadzono wyłącznie dla próbki ścieków surowych oraz po procesie filtracji na złożu z węgla aktywnego. Badanie to pozwoliło sprawdzić czy zadana dawka ozonu i ustalony czas kontaktu nie spowodowały zwiększenia stężenia bromianów jako wskaźnika substancji związków kancerogennych.
Jak widać w tabeli 5.1, stężenie bromianów w ściekach surowych oraz po procesie filtracji jest poniżej granicy wykrywalności metody. Wyniki te wskazują na to, że zastosowanie ozonowania jako metody usuwania farmaceutyków w oczyszczalni jest możliwe. Z uwagi na to, iż nie wykonano badania bromków w ściekach surowych, nie jest możliwe ustalenie czym spowodowany jest brak bromianów po procesie ozonowania. Korzystny wpływ na ograniczenie powstawania bromianów ma także zawartość materii organicznej oraz jonów amonowych w ściekach po osadniku wtórnym.
Bezpośrednio po pobraniu każdej z próbek wykonano pomiar temperatury każdej z nich. Założono, że temperatura ścieków może mieć duży wpływ na usuwanie farmaceutyków. Jest to związane z tym, że rozpuszczalność ozonu w wodzie maleje wraz ze wzrostem temperatury cieczy [4]. Oznacza to, że im wyższa temperatura ścieków, tym większa jest wymagana dawka ozonu do skutecznego przeprowadzenia procesu. Na podstawie powyższych wyników, można zaobserwować, że temperatura oczyszczanych ścieków była stosunkowo wysoka. Dlatego dawka ozonu musi być dopasowana także do tego parametru lub powinien być zastosowany system chłodzenia ścieków w przepływie.
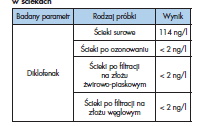
Badanie stężenia diklofenaku w ściekach przeprowadzono dla każdej z pobranych w trakcie badań próbek. Do roku 2018, w Polsce nie istniały żadne rozporządzenia dotyczące dopuszczalnych wartości tego parametru w ściekach oczyszczonych i najprawdopodobniej, w najbliższym czasie sytuacja ta nie ulegnie zmianie. Zdecydowano się na badanie stężenia diklofenaku, z uwagi na jego występowanie w odpływie z oczyszczalni, co potwierdziły badania przeprowadzone około pół roku wcześniej. Ozon, ze względu na swoje utleniające właściwości, powinien powodować obniżenie stężenia dikofenaku.
Pierwszym wnioskiem jaki nasuwa się obserwując wyniki badań zebrane w powyższych tabelach jest fakt, iż stężenie diklofenaku w ściekach po osadniku wtórnym było mniejsze, niż te wykryte w lutym 2018 roku. Stężenie diklofenaku w trakcie prowadzenia badań w stacji pilotowej było mniejsze aż o 3 214,6 ng/l, co oznacza, że w zimie było go o około 2800% więcej, niż w lecie. Jednym z czynników mających wpływ na te różnice ma pora roku. W zimie więcej ludzi choruje, co przekłada się na wykorzystywanie większej ilości farmaceutyków, a to automatycznie ma wpływ na wysokość ich stężeń w ściekach, w szczególności diklofenaku. Dodatkowym czynnikiem jest to, iż do oczyszczalni ścieki dopływają kolektorem ogólnospławnym, co oznacza, że ścieki sanitarne wymieszane są z deszczowymi. W wodzie opadowej do tej pory nie odnotowano wykrywalnych stężeń farmaceutyków, co oznacza, że rozcieńczenie ścieków sanitarnych, opadowymi, powoduje zmniejszenie wykrywalnej ilości diklofenaku. Przez kilka dni poprzedzających testy pilotowe instalacji usuwania farmaceutyków ze ścieków, na tym terenie występowały intensywne opady deszczu.
Jak widać w tabeli, proces ozonowania o parametrach zadanych w opisywanych badaniach pilotowych spowodował redukcję stężenia diklofenaku. Granica wykrywalności metody, określającej stężenie tego leku w ściekach, jest na poziomie 2 ng/l, dlatego wynik po procesie utleniania ozonem określono jako niższy od tej wartości. W trakcie badań osiągnięto skuteczność usuwania diklofenaku ze ścieków na poziomie około 98%, po samym procesie ozonowania. Z uwagi na granicę wykrywalności metody, nie było możliwe ustalenie czy stężenie diklofenaku jest dodatkowo redukowane w trakcie filtracji na złożu żwirowo-piaskowym oraz węglowym. Mimo tego, zastosowanie jednego z tych procesów jest konieczne, w celu usunięcia ze ścieków produktów utleniania. Przeprowadzone badania potwierdziły bardzo wysoką skuteczność usuwania diklofenaku, co wskazuje na to, iż technologia przyjęta dla stacji pilotowej spełnia swoją rolę oraz parametry procesu ozonowania były odpowiednio dobrane. Obserwując wyniki badań usuwania diklofenaku, zaczęto rozważać, czy w przypadku tak niskiego stężenia tego związku, nie został on całkowicie utleniony już w procesie napowietrzania powietrzem zjonizowanym. Z uwagi na to, iż w trakcie badań nie pobrano próbki ścieków bezpośrednio po tym procesie, nie można tego potwierdzić, jednakże jest to teza, która powinna zostać sprawdzona w kolejnych badaniach.
Podsumowanie i wnioski
Z uwagi na nie do końca poznaną toksyczność ciągłego oddziaływania farmaceutyków na środowisko, konieczne jest podjęcie działań zmierzających do ich usunięcia, już nie tylko w skali badawczej, ale w skali technicznej. Jest to problem, który dotyczy całego świata i z biegiem czasu będzie coraz poważniejszy z uwagi na ciągły rozwój medycyny oraz przemysłu farmaceutycznego, wzrost liczby ludności oraz chorób.
Przeprowadzone badania wykazały, że zarówno właściwości ozonu, jak i uwarunkowania technologiczne jego stosowania, umożliwiają jego efektywne wykorzystanie do usuwania farmaceutyków ze ścieków, a szczególnie diklofenaku. Z uwagi na duże zróżnicowanie matrycy ścieków wypływających z osadników wtórnych, konieczne jest indywidualne opracowanie procesu dla każdej z oczyszczalni. Wprowadzenie dodatkowych procesów oczyszczania ścieków w celu usuwania z nich farmaceutyków, powinno być poprzedzone przeprowadzeniem badań pilotowych, najlepiej w okresie jesienno-zimowym. W ich trakcie powinno być określone bezpieczeństwo wprowadzenia procesu oraz jego optymalne parametry, które zapewnią wysoką skuteczność działania.
Wykonanie badań procesu w skali technicznej, potwierdzających skuteczność ozonowania jako metody usuwania farmaceutyków ze ścieków, to duże wyzwanie technologiczne, logistyczne i finansowe. W wyniku przeprowadzonych badań otrzymano bardzo satysfakcjonujące wyniki, osiągając 98% skuteczność redukcji stężenia diklofenaku.
Dodatkowo nie zaobserwowano wzrostu stężenia bromianów, które mogą być ubocznym efektem procesu ozonowania i są dobrym wskaźnikiem powstawania ubocznych produktów utleniania. Dalsze badania powinny być kierowane w stronę optymalizacji procesu ozonowania, dostosowania jego pracy do dużej zmienności przepływów w oczyszczalniach ścieków oraz ograniczania powstawania produktów ubocznych procesu.
Niestety, często panuje przekonanie, że osiąganie parametrów ścieków oczyszczonych zgodnych z rozporządzeniami jest wystarczające. Prawidłową praktyką powinno być dążenie do ciągłego polepszania parametrów fizykochemicznych ścieków oczyszczonych, a nie zwykłe zadowalanie się spełnieniem ustawowego minimum, także z uwagi na to, iż nie wiadomo jakie zmiany w ustawodawstwie przyniesie przyszłość. Jeśli chodzi o mikrozanieczyszczenia, konieczne jest, aby kolejne kraje europejskie, w tym Polska, a w dalszej perspektywie wszystkie kraje świata wprowadziły normy i dokumenty prawne odpowiadające tym, ustanowionym w 2016 roku w Szwajcarii. Powinny one określać dopuszczalne stężenia kilku farmaceutyków przedostających się przez oczyszczalnie ścieków do ekosystemów. Bez takich regulacji prawnych miasta oraz przedsiębiorstwa wod – kan najprawdopodobniej nie będą inwestować wystarczającej ilości pieniędzy w takie rozwiązania technologiczne w oczyszczalniach ścieków, które zapewnią usuwanie farmaceutyków. Wprowadzenie omawianych regulacji prawnych przyniosłoby podobny skutek, jak w przypadku zaostrzenia wymagań dla ilości azotu i fosforu w odpływie z oczyszczalni ścieków, które np. w Polsce wymusiły inwestycje w bardziej efektywne oczyszczalnie ścieków, co pośrednio pozytywnie wpłynęło na zdrowie ludzi. Niestety, bez takich rozwiązań za kilkanaście lat możemy doprowadzić do nieodwracalnych zmian w środowisku, wywołanych przez nadmierną ilość farmaceutyków w wodach.
B I B L I O G R A F I A
[1] BOGDANOWICZ A., WĄSOWSKI J. Efektywność usuwania farmaceutyków i ich metabolitów w procesach uzdatniania wody. Gaz, Woda i Technika Sanitarna, Luty 2018.
[2] BOURGIN M., BECK B., BOEHLER M., BOROWSKA E., FLEINER J., SALHI E., TEICHLER R., VON GUNTEN U., SIEGRIST H., MCARDELL C. S. Evaluation of a full-scale wastewater treatment plant upgraded with ozonation and biological post-treatments: Abatement of micropollutants, formation of transformation products and oxidation by-products. Water research 129 (2018) 486-498.
[3] GRĘŹLIKOWSKA M. Bezpieczna siła ozonu z zastosowaniem systemu SPID w Wodociągach Jaworzno sp. z o.o. Kierunek Wod-Kan, 2/2018.
[4] GUZEL-SEYDIM Z. B., GREENE A.K., SEYDIM A.C. Use of ozone in the food industry. Lebensm.- -Wiss. u.-Technol. 37. 2004.
[5] HUBER M. M., GÖBEL A., JOSS A., HERMANN N., LÖFFLER D., MCARDELL C. S., RIED A., SIEGRIST H., TERNES T.A., VON GUNTEN U. Oxidation of Pharmaceuticals during Ozonation of Municipal Wastewater Effluents: A Pilot Study. Environ. Sci. Technol. 2005, 39, 4290 – 4299.
[6] Human Pharmaceuticals, Hormones and Fragrances. The challenge of micropollutants in urban water management. red. TERNES T. A., JOSS A. IWA Publishing, Londyn, 2006. ISBN10 :1843390930
[7] MCARDELL C. S. Efficiency of ozone technology for removal of micropollutants (including antibiotics) on the example of the upgraded wastewater treatment plant in Dübendorf, Switzerland. W: III Konferencja Naukowa “Ozon w Polsce”, Józefów, 2018.
[8] MUTSCHLER E., GEISSLINGER G., KROEMER H. K., RUTH P., SCHAEFER-KORTING M. Mutschler Farmakologia i Toksykologia. Wydawnictwo MedPharm Polska, 2010. ISBN 978-83-60466- 81-0
[9] SZYMONIK A., LACH J. Obecność farmaceutyków w wodach powierzchniowych i przeznaczonych do spożycia. W: Proceedings of ECOpole, 2013;7(2).
[10] SZYMONIK A., LACH J. Zagrożenie środowiska wodnego obecnością środków farmaceutycznych. Inżynieria i Ochrona Środowiska, 2012, t. 15, nr 3, s. 249-263.
[11] WĘGRZYN A., MACHURA M., ŻABCZYŃSKI S. Możliwości usuwania środków cieniujących ze ścieków. Ochrona Środowiska Vol. 37 nr 1, 2015.
[12] WONTORSKA K., WĄSOWSKI J. Problematyka usuwania farmaceutyków w procesach oczyszczania ścieków. Gaz, Woda i Technika Sanitarna, Styczeń 2018.
[13] WYDRO U., WOŁEJKO E., STRUK-SOKOŁOWSKA J., PUCHLIK M. Pozostałości farmaceutyków w środowisku oraz możliwości ich usuwania. 2016.
[14] ZHANG Y., GEIßEN S.-U., GAL C. Carbamazepine and diclofenac: Removal in wastewater treatment plants and occurrence in water bodies. Chemosphere 73, (2008), 1151-1161.
Occurrence and removal of residues drugs in water environment
Wstęp
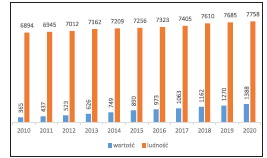
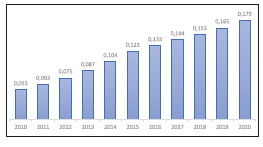
Dynamiczny rozwój przemysłu chemicznego w ostatnich latach, a szczególnie branży farmaceutycznej nie pozostał bez wpływu na zagrożenie zdrowia ludzi. Wzrost zużycia leków, a szczególnie leków dostępnych bez recepty (niesteroidowe leki przeciwzapalne i przeciwbólowe), spowodował ich przechodzenie do środowiska w coraz większym stopniu. W 2017 roku całkowita wartość rynku farmaceutycznego (w segmentach: apteczny Rx (refundowane i nierefundowane leki na receptę) i CH (leki i produkty dostępne bez recepty), szpitalny oraz sprzedaże wysyłkowe e-aptek, liczona w cenach detalicznych, wyniosła 38,3 mld zł, co oznacza wzrost o 4,9% czyli o 1,8 mld zł więcej niż w roku 2016. Segment leków i produktów dostępnych bez recepty (CH), stanowił 42,3% rynku aptek otwartych, wzrósł o 5,6%, czyli 723 mln zł w porównaniu do roku 2016 [17].
Ciągły wzrost wartości rynku farmaceutycznego (o 30% dla lat 2010-2020) przy 12% przyroście ludności w ww. latach będzie skutkował coraz większą liczbą farmaceutyków przedostających się do środowiska, co będzie wymuszało działania zmierzające do wprowadzenia do szerokiego stosowania skutecznych metod usuwania leków i ich metabolitów ze środowiska.
Sezonowość występowania
Przenikanie farmaceutyków do środowiska w postaci macierzystej bądź ich metabolitów charakteryzuje się dużą zmiennością zależną od miejsca (wyższe wartości stężeń farmaceutyków i metabolitów występują w dużych miastach) i czasu (pory roku) pobrania. Potwierdził to zespół badaczy z Kalifornii [43], analizując stężenie czternastu farmaceutyków, substancji zaburzających gospodarkę hormonalną człowieka i produktów do higieny osobistej. Potwierdzono wyższe stężenie paracetamolu, naproksenu i ibuprofenu w okresie zimowym niż letnim. Spowodowane to było zwiększonym zużyciem farmaceutyków w okresie zimowym, a także faktem, że w miesiącach letnich następuje szybsza degradacja farmaceutyków i ich metabolitów pod wpływem wyższej temperatury oraz to, że w przypadku substancji wrażliwych na światło słoneczne, reakcja fotolizy może powodować rozpad cząsteczek, szczególnie w wodach powierzchniowych.
Historia badań
Historia badań ilości pozostałości leków w środowisku jest stosunkowo krótka:
1981 – stwierdzenie obecności oraz ilościowe oznaczenie kwasu klofibrowego w próbkach środowiskowych (USA),
1997 – oznaczenie pozostałości farmaceutyków w ściekach szpitalnych (Niemcy),
1997 – badania dotyczące toksyczności antybiotyków w środowisku wodnym (Dania),
1998 – monitorowanie wód rzecznych i ścieków na obecność pozostałości farmaceutyków (Niemcy),
1998 – oznaczenie związków z grupy antybiotyków w różnych próbkach wody (Niemcy),
1999 – opracowanie metodyki analitycznej umożliwiającej stwierdzenie obecności estrogenów w wodach powierzchniowych (USA),
2002 – pierwsza metodyka jednoczesnego oznaczania pozostałości wielu farmaceutyków w próbkach środowiskowych (Dania),
2001-2002 – oznaczenie pozostałości farmaceutyków w wodach przeznaczonych do spożycia przez ludzi (Niemcy),
2003 – opracowanie odpowiednich modeli matematycznych do przewidywania stężenia i losu poszczególnych farmaceutyków w środowisku (Belgia),
2005 – oznaczanie pozostałości farmaceutyków w próbkach stałych (Hiszpania) [27].
Leki są biologicznie czynną grupą związków o negatywnym działaniu na różne ekosystemy. Raporty (np. tzw raport Posejdon) ujawniają dane, które potwierdzają powszechność występowania pozostałości leków w dopływie i odpływie z oczyszczalni ścieków, wodach powierzchniowych (rzekach, jeziorach, strumieniach), wodzie podziemnej, wodzie do picia, a nawet morskiej [26].
Niesteroidowe leki przeciwzapalne
Leki te są substancjami chemicznymi, aktywnymi biologicznie, modyfikującymi procesy biochemiczne zachodzące w organizmach ludzkich i zwierzęcych. Najwyższe ich stężenia w środowisku stwierdzono dla niesteroidowych leków przeciwzapalnych, takich jak:
Najlepiej zbadanym farmaceutykiem jest diklofenak. Szerokie zastosowanie diklofenaku jako środka przeciwbólowego, anty-artretycznego i przeciwreumatycznego dla ludzi i zwierząt uplasowało go jako jedno z głównych zanieczyszczeń farmakologicznych środowiska. W badaniach sprawdzono m.in. wpływ diklofenaku na pstrąga tęczowego, badania te wykazały zmiany zwyrodnieniowe w nerkach i skrzelach. Zmiany te, w znacznym stopniu pogarszają ogólny stan zdrowia i obniżają wydolność organizmu[32]. Diklofenak jest lekiem charakteryzującym się dużą trwałością i toksycznością. Skuteczność usuwania diklofenaku metodą osadu czynnego w dużej mierze zależy od początkowego stężenia. Przy stężeniu wynoszącym 1μg/ dm³ efektywność oczyszczania wynosi 71%, natomiast przy stężeniu ok 3μg/dm³ spada do 17% [45].
Inne farmaceutyki w środowisku
Do środowiska przenikają różnorodne grupy leków a ich oznaczanie oraz ich metabolitów wymaga standaryzacji procedur badawczych. Różne rodzaje metod usuwania farmaceutyków w oczyszczalniach ścieków wynikające z różnych technologii, czasu pobrania próbek i umiejscowienia geograficznego powodują znaczne różnice uniemożliwiające prawidłową ocenę zagrożeń powodowanych przez farmaceutyki i ich metabolity.
Często stosowanym antybiotykiem zarówno dla ludzi jak i zwierząt jest amoksycylina, która jest półsyntetyczną penicyliną o szerokim spektrum działania. Lek ten bardzo szybko ulega rozpadowi przez co nie stanowi zagrożenia dla środowiska. Dlatego też ważnym problemem jest kompleksowa identyfikacja leków i ich metabolitów w celu określenia metod ich usuwania i wpływu na środowisko.
Innym stosowanym antybiotykiem jest sulfametoksazol, lek o dużej trwałości, wydalany z moczem w postaci niezmienionej w ilości ok. 30% podanej dawki, podczas procesu oczyszczania ścieków usuwany w ok. 13% [18].
Zawartość farmaceutyków w środowisku i ich usuwalność
Pojawia się coraz więcej publikacji poruszających temat występowania leków i ich metabolitów w wodach powierzchniowych, podziemnych, wodzie do picia, a także w oczyszczalniach ścieków, co potwierdzono m.in. w Chinach, Korei, Indiach, Francji, Hiszpanii, Portugalii, Grecji oraz Szwecji [11], [12], [13], [16], [24], [21], [22].
Określana w publikacjach usuwalność farmaceutyków i ich metabolitów nie daje odpowiedzi na pytanie: czy usunięte leki podczas oczyszczania ścieków z wykorzystaniem osadu czynnego są usuwane poprzez ich rozpad czy następuje ich kumulacja w nadmiernym osadzie ściekowym. Biorąc pod uwagę fakt, że osady ściekowe są często wykorzystywane jako środek nawozowy (ze względu na ich różnorodny w składniki pokarmowe skład chemiczny), należy zadać pytanie o skuteczność usuwania ze ścieków, a tym samym z osadów leków i ich metabolitów, oraz czy pozostałości leków są wymywane do gleby i absorbowane przez rośliny.
Jak wynika z tabeli 3 występują znaczne wahania w skuteczności usuwania farmaceutyków wynikające z metody oczyszczania ścieków i sezonowości. Należy także podkreślić brak standaryzacji metod oznaczania farmaceutyków, co może powodować rozbieżność oznaczeń.
Dotychczas stosowane metody oczyszczania ścieków z zastosowaniem osadu czynnego nie zapewniają całkowitego i bezpiecznego dla środowiska usunięcia farmaceutyków.
Metody usuwania farmaceutyków z wody do picia i ścieków
W celu usunięcia pozostałości farmaceutyków w procesie produkcji wody do picia stosuje się metody:
–– filtracja powolna na filtrach piaskowych,
–– ozonowanie,
–– techniki oparte na procesie zaawansowanego utleniania (AOP’s),
–– utlenianie elektrochemiczne (EAOP’s),
–– adsorpcja na granulowanym węglu aktywnym (GAC),
–– techniki membranowe [30].
O ile dla oczyszczania wody do picia można stosować wiele różnorodnych bardzo skutecznych technik, to przy oczyszczaniu ścieków stosuje się konwencjonalne metody oparte na dwóch etapach oczyszczania: fizycznego i chemicznego. Tylko na kilku obiektach stosuje się bardziej zaawansowane metody oczyszczania, takie jak: ultrafiltracja, flokulacja, ozonowanie, zaawansowane utlenianie lub odwróconą osmozę czy nanofiltrację. Mimo wysokiej skuteczności metod zaawansowanych ich użycie jest ograniczone głównie z powodu mniejszej wydajności (w porównaniu do metod konwencjonalnych) oraz wysokich kosztów stosowania tych metod [10], [34].
Konwencjonalne metody oczyszczania ścieków z farmaceutyków i ich metabolitów w standardowych oczyszczalniach ścieków nie pozwalają na ich skuteczne biodegradowanie do dwutlenku węgla i wody bądź na ich pełną adsorpcję w osadach ściekowych.
Niestety przy tych metodach część farmaceutyków lub metabolitów trafia w postaci niezmienionej do środowiska [7]. W opracowaniu Kosjek i in. [22], przeprowadzono badania czterech najpopularniejszych farmaceutyków należących do grupy niesteroidowych leków przeciwzapalnych; diklofenak, ibuprofen, naproksen i ketoprofen. Badania przeprowadzono w słowackiej pilotażowej oczyszczalni ścieków, uzyskano wysoki stopień eliminacji ibuprofenu, naproksenu i ketoprofenu (< 87% ), natomiast skuteczność usuwania diklofenaku była dużo niższa i wynosiła 49 – 59%.
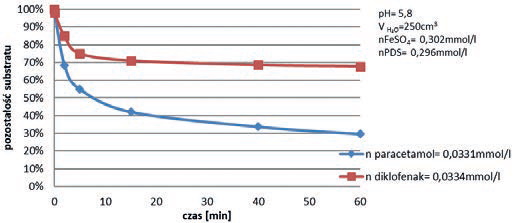
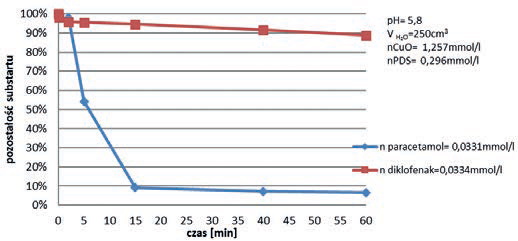
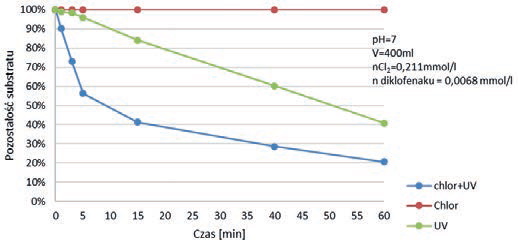
Diklofenak jest związkiem odpornym na destrukcję, również w przypadku użycia nowoczesnych silnych utleniaczy. W dalszej części artykułu przedstawiono wyniki badań autorów nad destrukcją diklofenaku, popularnego niesteroidowego leku przeciwzapalnego, w procesie utleniania go nadtlenodisiarczanem potasowym (PDS) aktywowanym jonami żelaza (II) i tlenkiem miedzi (II) oraz utleniania metodą chlor/UV. Reakcja destrukcji leku, w przypadku aktywacji jonami Fe(II) biegnie według mechanizmu rodnikowego generującego rodniki SO4*-. Natomiast reakcja PDS aktywowanego tlenkiem miedzi biegnie według nie do końca jeszcze wyjaśnionego mechanizmu, niemniej nie jest to mechanizm rodnikowy. Chlor natomiast, popularny niegdyś środek dezynfekujący, został odsunięty ze względu na tworzenie się szkodliwych, ubocznych produktów. Wraca jednak do łask w połączeniu z promieniowaniem UV [33]. Wyniki eksperymentów przedstawiono na rys. 8, 9 i 10. W przypadku zastosowania reakcji z PDS, porównawczo destrukcji poddawano również paracetamol.
Rezultaty jasno wskazują, iż w reakcji ww. leków z PDS aktywowanym jonami Fe(II) paracetamol ulega destrukcji w 70%, gdy taka sama ilość diklofenaku ulega destrukcji w ok. 30%.
Natomiast rezultaty osiągnięte w reakcji ww. leków z PDS aktywowanym CuO, wskazują iż paracetamol ulega niemal pełnej destrukcji (powyżej 90%) już w 15 minucie procesu, gdy taka sama ilość diklofenaku ulega nieznacznej destrukcji, w ilości ok. 10%.
Uzyskane wyniki wskazują, iż niezależnie od sposobu aktywacji PDS, diklofenak wykazuje relatywnie wysoką odporność na utlenianie.
Rysunek 10 przedstawia krzywą destrukcji diklofenaku w procesie utleniania chlor/UV – w porównaniu do działania na ten lek samym chlorem oraz samym promieniowaniem UV.
Również ten proces pokazuje dużą odporność diklofenaku na destrukcję – przy zastosowaniu bardzo wysokiego jak na standardy chlorowania stężenia chloru (0,211mmol/l), po godzinie trwania procesu pozostaje jeszcze ponad 20% leku. Badania wskazują na zerową wrażliwość diklofenaku na chlor i dużą odporność na promieniowanie UV (40% diklofenaku pozostaje po godzinie naświetlania).
Ostatnio coraz większym zainteresowaniem zaczynają cieszyć się bioreaktory membranowe, których niewątpliwą zaletą jest możliwość usuwania wielu rodzajów zanieczyszczeń organicznych [3].
Inną propozycją na oczyszczanie ścieków z farmaceutyków i metabolitów jest zastosowanie grzybów białej zgnilizny, które wydzielają oksydacyjne zewnątrzkomórkowe enzymy, takie jak: peroksydaza ligniny, peroksydaza manganu i lakaza. Metodą tą udało się wyeliminować ze środowiska takie trwałe zanieczyszczenia, jak: syntetyczne barwniki, WWA i PCB. Badano potencjalną zdolność tych grzybów do eliminacji takich farmaceutyków, jak: leki antydepresyjne, leki przeciwzapalne, leki przeciwpadaczkowe, uspokajające [30].
Content of selected pharmaceuticals in wastewater, surface water and drinking water, [4], [40], [42], [1], [8], [15], [41], [44], [20], ed. [5]
Concentrations of selected pharmaceuticals at the inlet and outlet of sewage treatment plants and cleaning efficiency [35]
Methods for removing pharmaceutical residues during the production of drinking water and wastewater [30], [25]
Podsumowanie
Na podstawie wyników badań można stwierdzić, że oczyszczalnie ścieków oparte na konwencjonalnych procesach oczyszczania ścieków nie mogą zapewnić całkowitego, bezpiecznego dla środowiska usunięcia farmaceutyków i ich metabolitów.
Podczas oczyszczania leki mogą ulec biodegradacji do dwutlenku węgla i wody, ulec częściowemu metabolizmowi, przejść w postaci niezmienionej do środowiska lub ulec adsorpcji na osadzie ściekowym. Szczególnie ostatnie trzy przypadki wymagają ingerencji w proces oczyszczania. Znane są metody skutecznego oczyszczania wody z leków lecz są one zbyt kosztowne bądź zbyt zaawansowane technologicznie by móc je zastosować na skalę przemysłową. W dodatku wykazano, że niektóre popularne leki są odporne na działanie nawet silnych środków utleniających.
Badania wykazują znaczne różnice w skuteczności usuwania leków w zależności od ich rodzaju i budowy, ze względu na ilość związków należy jak najszybciej opracować metodę usuwania jak największej ilości leków i ich metabolitów w jednym procesie w celu ograniczenia ich przedostawania się do środowiska.
Konieczne jest opracowanie norm określających dozwolone i bezpieczne maksymalne stężenie farmaceutyków w wodzie zrzutowej i w osadach ściekowych. Z tego samego względu należy opracować szczegółowe procedury oznaczania farmaceutyków.
B I B L I O G R A F I A :
[1] Baranowska I., Kowalski B. A rapid UHPLC method for the simultaneous determination of drugs from different therapeutic groups in surface water and wastewater. Bull Environ Contam- Toxicol 2012, 89: 8-14.
[2] Baronti C., Curini R., D’Ascenzo G., Di Corcia A., Gentili A., Samperi R., (2000) 5059
[3] Bo L., Urase T., Wang X.,Biodegradation of trace pharmaceutical substances in wastewater by a membrane bioreactor, Frontiers of Environmental Science & Engineering, 2009, Vol. 3, No. 2,236-240.
[4] Boleda MR, Galceran MT, Ventura F. Behavior of pharmaceuticals and drugs of abuse in a drinking water treatment plant (DWTP) using combined conventional and ultrafiltration and reverse osmosis (UF/RO) treatments. Environ Pollut 2011, 159: 1584-1591.
[5] Boroń M., Pawlas K. Pharmaceuticals in aquatic environment, Probl. Hig. Epidemiol. 2015,96(2), 357-363
[6] Carballa M., Omil F., Lema J.M., Llompart M., Garcia-Jares C., Rodriguez I., Gomez M., Ternes T., Water Res., 38 (2004) 2918.
[7] Czerwiński J., Kłonica A., Ozonek J., Pozostałości farmaceutyków w środowisku wodnym i metody ich usuwania, Czasopismo Inżynierii Lądowej, Środowiska I Architektury, 2015, 27–42.
[8] Daneshvar A, Svanfelt J, Kronberg L, et al. Winter accumulation of acidic pharmaceuticals in a Swedish River. Environ Sci Pollut Res 2010, 17: 908-916.
[9] Dudziak M., Luks-Betlej K., Ocena obecności estrogenów-steroidowych hormonów płciowych w wybranych wodach rzecznych w Polsce, Ochrona Środowiska 2004, 26, 21-24.
[10] Fatta-Kassinos D., Meric S., Nikolau A., Pharmaceutical residues in environmental waters and wastewater: current state of knowledge and future research, Analytical and Bioanalytical Chemistry, 2011, Vol. 399, 251–275.
[11] Flick J., Lindberg R.H., Tysklind M., Larsson D.G.J.,: Predicted critical environmental concentrations for 500 pharmaceuticals. Regulatory Toxicology and Pharmacology. 2010.
[12] Gabet-Giraud V., Miege C., Choubert J.M., Martin Ruel S., Coquery M.,: Occurrence and removal of estrogensand beta blokers by various processes in wastewatertreament plants.”Sci. Total Eviron.” 19/2010.
[13] Gilart N., Marce R.M., Borrull F., Fontanals N., Determination of pharmaceuticals in wastewaters using solidphase extraction – liquid chromatography – tandem mass spectrometry, J.Sep. Sci 2012, 35, 875-882.
[14] Heberer T., Occurrence, fate and removal of pharmaceutical residues in the aquatic environment: a review of recent research data.”Toxicology Letters” 131/2012.
[15] Helenkar A, Sebők A, Zaray G, et al. The role of the acquisition methods in the analysis of the non-steroidal antiinflammatory drugs in Danube River by gas chromatography– mass spectrometry. Talanta 2010, 82: 600-607.
[16] Hrenando M.D., Gomez M.J., Aguera A., Fernandez- Alba A.R.: LC-MS analysis of basic pharmaceuticals (beta-blokers and anti-ulcer agent) in wastewater and surface water.”Trends in Analitycal Chemistry” 26/2007.
[17] IQVIA,Rynek farmaceutyczny w 2017 roku, Warszawa, styczeń 2018,
[18] Karthikeyan K.G., Meyer, Sci M.T., Total Environ., 361 (2006) 196
[19] Kasprzyk-Hordern B., Dąbrowska A., Vieno N., Kronberg L., Nawrocki J., Occurrence of acidic pharmaceuticals in the Warta River in Poland, Chem. Anal. 2007, 52, 289-303.
[20] Kasprzyk-Hordern B, Dinsdale RM, Guwy AJ. The removal of pharmaceuticals, personal care products, endocrine disruptors and illicit drugs during wastewater treatment and its impact on the quality of receiving waters. Water Res 2009, 43: 363-380.
[21] Khetan S.K., Collins T.J.,: Human pharmaceuticals in the Aquatic Environment: A Challenge to GreenChemistry.”Chem.Rev.”107/2007
[22] Kosjek T., Heath E., Kompare B.,: Removal of pharmaceutical residues in a pilot wastewater treatment plant.”Anal.Bioanal.Chem.” 387/2007.
[23] Kot-Wasik A., Dębska J., Namieśnik J., Pozostałości środków farmaceutycznych w środowisku przemiany, stężenia, oznaczenia, Chemia i Inżynieria Ekologiczna 2003, 10, 723-750.
[24] Liying J., Jun Y., Jianmeng C.: Isolation and characteristic of 17β-estradiol-degrading Bacillus spp.strains from activated sludge Biodegradation 9/2010.
[25] Luo Y., Guo W., Ngo H.H., Nghiem L.D., Hai F.I., Zhang J., Liang S.,Wang X.C., A review on the occurrence of micropollutants in the aquatic environment and their fate and removal during wastewater treatment, Science of the Total Environment, 2014, Vol. 473-474, 619-641
. [26] Magner J., Filipovic M., Alsberg T.,: Application of a novel solid phase extraction sampler and ultra performance liquid chromatography quadrupole- time-of-flighmass spectrometry for determination of pharmaceutical residues in surface sea water. “Chemosphre” 80/2010.
[27] Namieśnik J., Analityka pozostałości farmaceutyków w próbkach środowiskowych, Warszawa 2010
[28] Nikolaou A., Meric S., Fatta D., Occurrence patterns of pharmaceuticals in water and wastewater environments, Anal. Bioanal. Chem. 2007, 387, 1225-1234.
[29] Quintana J.B., Weiss S., Reemtsma T., Water Res., 39 (2005) 2654
[30] Rivera-Utrilla J., Sanchez-Polo M., Ferro-Garcia M.A., Prados-Joya G., Ocampo-Perez R., Pharmaceuticals as emerging contaminants and their removal from water. A review, Chemosphere, 2013, Vol. 93, 1268-1287.
[31] Roberts P.H., Thomas K.V., Sci. Total Environ., 356 (2006) 143.
[32] Schwaiger J., Ferling H., MallowU., Wintermayr H., Negele R.D.,: Toxic effects of the non-steroidal anti-inflammatory drug diclofenac.AQuat. Toxiol., 2004;68:141-150
[33] Sicher C., Garcia C., Andre K., Feasibility studies: UV/chlorine advanced oxidation treatment for the removal of emerging contaminants, Water Research 45, 6371-6380, 2011.
[34] Sires I., Brillas E., Remediation of water pollution caused by pharmaceutical residues based on electrochemical separation and degradation technologies: A review, Environment International 2012, Vol. 40, 212–229.
[35] Sosnowska K., Grochowiak-Styszko K., Gołas J., Leki w środowisku-źródła, przemiany, zagrożenia, Krakowska Konferencja Młodych Uczonych, 2009.
[36] Szymonik A., Lach J., Zagrożenie środowiska wodnego obecnością środków farmaceutycznych, Inżynieria i Ochrona Środowiska, 2012, t15/3, 249-263.
[37] Tauxe-Wuersch A., Alencastro L.F.D., Grandjean D., Tarradellas J., Water Res., 39 (2005) 1761.
[38] Ternes T.A., Water Res., 32 (1998) 3245.
[39] Thomas P.M., , Foster G.D., Environ J., Sci. Health, A, 39 (2004) 1969
[40] Togola A, Budzinski H. Multi-residue analysis of pharmaceutical compounds in aqueous samples. J Chromatogr A, 2008, 1177: 150-158.
[41] Valcárcel Y, González Alonso S, Rodríguez-Gil JL, et al. Analysis of the presence of cardiovascular and analgesic/ anti-inflammatory/antipyretic pharmaceutical in river – and drinking-water of the Madrid Region in Spain. Chemosphere2011, 82: 1062-1071.
[42] Wang L, Ying GG, Zhao JL, et al. Occurrence and risk assessment of acidic pharmaceuticals in the Yellow River, Hai River and Liao River of north China. Sci. Total Environ 2010, 408: 3139- 3147.
[43] Yu Y, Wu L, Chang AC,: Seasonal variation of endocrine disrupting compounds, pharmaceuticals and personal care products in wastewater treatment plants. Sci. Total Environ 2013, 442; 310-316.
[44] Zgoła-Grześkowiak A. Application of DLLME to isolation and concentration of non-steroidal anti- -inflammatory drugs in environmental water samples. Chromatogr. 2010, 72:671‑678
[45] Zhong D.F., Sun L., Liu L., Huang H.H.,: Microbial transformation of naproxen by Cunninghamella species. Acta Pharmacol. Sin.,2003;24:442-447.

![Badanie skuteczności usuwania,rys1 Rys. 2.1 Struktura cząsteczki diklofenaku [14]](https://informacjainstal.com.pl/wp-content/uploads/2020/02/Badanie-skuteczności-usuwaniarys1.jpg)
![Badanie skuteczności usuwania,tab1 Tab. 4.1 Wyniki oznaczeń wybranych farmaceutyków w próbkach ścieków surowych i oczyszczonych [3]](https://informacjainstal.com.pl/wp-content/uploads/2020/02/Badanie-skuteczności-usuwaniatab1.jpg)


![Występowanie oraz usuwanie,rys3 Fig.3. Seasonal variability of pharmaceutical condensation in untreated wastewater in California, USA [43, modified]](https://informacjainstal.com.pl/wp-content/uploads/2020/02/Występowanie-oraz-usuwanierys3.jpg)
![Występowanie oraz usuwanie,tab1 Table 1. Other drug groups present in the environment – surface waters, [36]](https://informacjainstal.com.pl/wp-content/uploads/2020/02/Występowanie-oraz-usuwanietab1.jpg)
![Występowanie oraz usuwanie,tab2 Table 2. Content of selected pharmaceuticals in wastewater, surface water and drinking water, [4], [40], [42], [1], [8], [15], [41], [44], [20], ed. [5]](https://informacjainstal.com.pl/wp-content/uploads/2020/02/Występowanie-oraz-usuwanietab2.jpg)
![Występowanie oraz usuwanie,tab3 Table 3. Concentrations of selected pharmaceuticals at the inlet and outlet of sewage treatment plants and cleaning efficiency [35]](https://informacjainstal.com.pl/wp-content/uploads/2020/02/Występowanie-oraz-usuwanietab3.jpg)
![Występowanie oraz usuwanie,rys7 Fig. 7. Methods for removing pharmaceutical residues during the production of drinking water and wastewater [30], [25]](https://informacjainstal.com.pl/wp-content/uploads/2020/02/Występowanie-oraz-usuwanierys7.jpg)